 |
日本免疫毒性学会20周年記念
免疫毒性研究の温故知新
―免疫毒性学会の発足経過と20周年への提言 |
大沢 基保
(財)食品薬品安全センター秦野研究所) |
2012年の日本免疫毒性学会第19回大会で、上記表題について学会員諸氏に話す機会をいただいた。歴史としてはまだ浅いが、日本の免疫毒性研究母体である学会とその前身の研究会の発足に関わった者には、それぞれの発足経過とその初志を継承する務めがあるので、その経過をできるだけ記録に残し、新たな方向を目指すための参考に供したいと思う。そこで、過日の大会時の話の主な内容を、言及し得なかった点等を補いながら、ここに記す次第である。
はじめに
日本の免疫毒性研究は、当初薬理、毒性、衛生等関連の各学会の中で論じられて来たが、それらを集約し研究を深める場として免疫毒性研究会が1994年に発足した。この研究会は、2001年には研究の進展にあわせ学会(The
Japanese Society of Immunotoxicology: JSIT)に発展し、今年2013年には通算20回目の年会を迎えようとしている。米国ではThe Society of Toxicology(SOT)の中にImmunotoxicology Specialty Section(ITSS)が早くから設立され、近年その歩みの回顧・展望もなされている1,2)。免疫毒性の研究は、およそ10年単位でその課題が推移しているように見える。JSITでも先に通算10年を経た段階で一区切りとしての総括を試みている3)。現在までの全般的な学会の発展と将来の展望については、20周年の記念大会で予定されている澤田純一学会理事長のご講演に委ねて、今回は、学会の設立までの経過を中心に紹介し、免疫毒性研究の目指したところと学会の果たした役割を振り返り、その後の研究環境の変化も考えつつ今後の学会への期待について述べてみたい。
1 .免疫毒性研究の始まりと展開
免疫の異常は、異常亢進による自己免疫やアレルギーと抑制による免疫不全に大別される。免疫異常は先天的要因や感染因子によって生じるが、薬物や化学物質によっても生じる。この薬物や化学物質による免疫異常を、今日では免疫毒性(Immunotoxicity)と称し、その研究領域を免疫毒性学(Immunotoxicology)と呼んでいる。天然毒素や化学物質に対して免疫反応が過度に働くアレルギーは、1900年代初頭から既に知られており、免疫研究の特殊な分野とされていた。一方、免疫抑制については、1960年代後半頃から発がん物質の免疫抑制作用や、免疫抑制薬による感染あるいは家畜の易感染性とその要因などの問題を通して関心が持たれていた。免疫毒性研究の流れは、図1 に示すようにこれらに端を発している。1970年代には化学物質や医薬品などによる免疫抑制の毒性学研究が盛んになり、70年代末にこれを免疫毒性と称することで免疫系を毒性標的として扱い始めた。
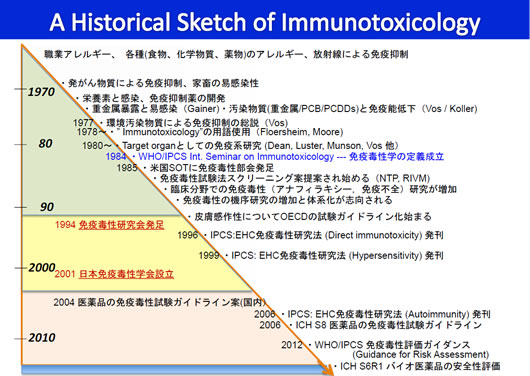 図1 免疫毒性研究の流れ 1 )免疫毒性研究の始まり
1970年代は、実験動物の感染に対する抵抗性が重金属暴露により低下することや、PCB/ダイオキシンなどの暴露によりリンパ系組織に選択的な病理変化が生じることに始まり、その原因としてこれら汚染化学物質の暴露による液性および細胞性の免疫機能の低下が見出され、免疫抑制の関与が示されるようになった(Gainer, Vos,
Kollerらの研究によるところが大きい)。これらおよびDr. Vosによるトキシコロジー分野の免疫抑制についての文献的総説(1977)4)により、免疫系は化学物質毒性の標的となりうることが注目された。免疫抑制を主とするその毒性は、Immunotoxicityとも称され始めた。一方、医薬品についても、抗がん剤による免疫抑制や輸液栄養の微量金属組成と易感染性の関係などが指摘されていたが、医薬品による免疫異常も本格的に免疫毒性研究の対象になるのは80年代になってからである。この間の推移は、Immunotoxicologyの成書5,6)にも簡潔に述べられている。
Immunotoxicologyの語は、70年代半ばに欧州の一部で使われたが、70年代後半に薬物や食品成分、化学物質の有害な免疫影響を対象にして再び提唱7-9)され、普及するようになった。とくに、Drug Safetyに関連する免疫影響についてGordon Research Conference(1978)が開かれ、Dr. Mooreの"The Immunotoxicology Phenomenon"と題する総論7)に始まるシンポジウム記録(Drug and
Chemical Toxicology誌の特集:Dr. Deanの編集)は、研究の流れを一気に加速した。その研究過程で、免疫系やその機能は毒性感受性が高いこと、感染免疫の低下はウイルス発がんを含む感染症の発症を促進することなどが明らかになり、免疫毒性への主な関心は獲得免疫能の抑制とその影響に向けられた。日本では、荒川泰昭先生が70年代前半で既に免疫毒性学を提唱されていて10)、その後免疫毒性の語もいち早く使われたとのことで、その先見の明に敬服する次第である。この頃筆者は、カドミウム暴露による腎障害指標であるβ2-microglobulinの研究から、重金属とリンパ球増殖との関係11)に興味を持っていた。免疫機能変化が環境汚染物質暴露の鋭敏な影響指標となりうると考え、Dr. Kollerのもとでの研究なども計画したものである。免疫系は神経系、内分泌系と同様に生理機能の基本的な調節系であり、その毒性障害は免疫抑制だけでなく免疫毒性と呼ぶべき系機能の障害として多様な発現様式をとり、健康影響の潜在的リスクになるだろうと考えていたが、毒性標的としての免疫系という概念にまでは踏み切れていなかった。それについては、前記のGordon Conferenceでも"Immunotoxicology
Phenomenon"と慎重な表現を使っているが、当時筆者自身は在米中ながら別の研究課題に従事していたため、そのシンポジウムのことは耳にせずじまいであった。
2 )免疫毒性学の成立と展開
1980年代には、研究対象が医薬品全般の副作用にも及び、免疫系が化学物質毒性の一次標的となることやその作用機構の解析に研究が向けられ、一方、免疫毒性試験の体系化に向けた試験法の開発や評価などに集約されていった。これらに伴い、多様な免疫機能の攪乱により化学発がんや自己免疫症の促進を含む種々の健康影響を生じうることが明らかにされた。その当初、免疫毒性に関する国際会議が幾つかもたれ、免疫毒性研究は二つの視点から論じられた。すなわち、免疫系に及ぼす毒性の特異性に注目するToxico-Immunologyの視点と、免疫系の毒性に対する高感受性と影響の多様性に注目するImmuno-Toxicologyの視点である。これらは、重きをどちらに置くかの相対的な問題にすぎず、両方の視点ともに免疫毒性研究には必要であるが、当面は免疫機能の抑制が免疫毒性の主対象となり、毒性学的観点からのアプローチが主であるImmunotoxicologyとして展開してきた。さらに、1983年の国際トキシコロジー会議(IUTOX,
San Diego)でもImmunotoxicologyのOral Sessionが初めて設けられ、筆者も演題を出し発表に加わった。Dr. Vos
が熱心に質問してくれたのが印象深かった。このような経緯を経て、1984年のUNEP/ILO/WHO合同の国際化学物質安全性計画(IPCS)とEC委員会(当時)共催の「毒性標的としての免疫系」国際セミナー(Luxembourg)が開かれた。野見山一生教授(自治医大)はじめ衛生分野の先生方の薦めにより、幸いにも筆者は会議の一部の進行役を担うべく、ただ一人の日本の研究者として参加する機会を得た。そこで、Immunotoxicity(免疫毒性)は生体異物(主に化学物質や薬物)と免疫系との相互作用の結果として有害影響(感染や発がんに対する生体防御能の低下、過敏症や自己免疫疾患)を生じるような事象として、またImmunotoxicology(免疫毒性学)はそれに関する研究分野と定義された12,13)。冒頭に述べたように米国では、この会議後早くも1985年にSOTの中に専門部会としてITSSが創設され、研究推進の核が形成されていた。
この時期には化学物質による免疫抑制を主とする免疫毒性が、1 )感受性が高く環境汚染の早期健康影響指標になることや、2 )変異原性を示さぬ(有機塩素化合物、エストロゲン類など)あるいは変異原性が弱い物質や、発がんプロモーター(Phorbol estersなど)について発がんリスクを評価する補助指標になりうることが示され、また、3 )多様な健康影響に共通する毒性発現機序または潜在的リスクでありうることが示唆された。一方、臨床分野ではサイトカインや生物学的製剤など薬物の多様化や長期投与を要する医薬品によるアナフィラキシーや免疫不全への対応の重要性が増し、80年代後半から医薬品の免疫毒性研究はアレルギーや免疫抑制の他に免疫亢進に伴う免疫障害に関するものが多くなった。さらに、実際に発生した重金属や有機化合物(PBB/ダイオキシン類、アニリン変性油など)による生活環境や食品の汚染事件において、健康リスク指標として免疫毒性が検討されるようになった。Immunotoxicologyを冠する成書14,15)にこれらの成果がまとめられ、研究領域としての基盤は確実に整えられた。
90年代になると、免疫の細胞・分子的機構についての知識が深まるとともに、免疫毒性の機序と試験のためのバイオマーカーの研究が進展した。また、WHO/IPCSのTask groupによって免疫系を毒性の一次標的とするDirect Immunotoxicityの概念と研究法を体系的にまとめる作業が始まり、Environmental Health Criteria
documentationとして1996年に刊行された16)(このEHCシリーズでは、ひきつづきHypersensitivityとutoimmunityが刊行されている)。このような背景のもとに米国のITSSより9 年程遅れたが、わが国の免疫毒性研究会は発足したのである。
2 . 免疫毒性研究会の発足と日本免疫毒性学会の設立
1 )研究会の発足経過
日本では従来医薬品や化学物質による免疫影響は、抗原性や皮膚感作性などの免疫刺激作用の有無が特殊毒性として試験されてきた。日本でも80年代初めには汚染物質や医薬品について感染や発がんリスクと免疫機能障害の関係が注目され始め、免疫抑制作用に注目した免疫毒性の研究発表や試験法の紹介がなされるようになった。しかし、欧米に比べ研究分野の構築の動きは鈍く、もっぱら研究者個々の興味と努力に依存し、研究のコアとなる免疫毒性情報の交換の場は整っていなかった。
日本で研究領域としての免疫毒性の用語使用と集会は、日本衛生学会の第1 回重金属ワークショップ「免疫毒性と金属」(1984年10月、東京)に始まるように思う。それにつぐ前述のIPCSセミナーの報告や免疫毒性の総説17,18)、化学物質や医薬品を対象とする免疫毒性試験法の紹介等により、広く関心がもたれるようになった。さらに、毒科学研連シンポジウム(1986)でも免疫毒性のIn vitro試験法が取り上げられ、免疫薬理分野ではImmunomodulatorを中心に薬理と毒性の両面で議論されるようになった。90年代に入り黒岩幸雄教授(昭和大)の尽力により毒科学研連シンポジウム(1990)、ついで毒科学会のサテライトシンポジウム(1992)で、毒性標的の観点から免疫毒性がはじめて取り上げられた。 一方、90年代に入り日本の若手研究者の方々が米国に渡り、NIEHSのDr.
Lusterのもとで免疫毒性を学んでこられ、研究情報の集約の場を求めておられた。これらを契機として研究者有志が呼びかけ(1994年6 月)、名倉宏教授(東北大)を代表幹事とする9 人の幹事のもとに176名の会員をもって研究会が正式に発足した。最初の研究会は吉田武美先生を世話人として東京(昭和大学、1994年10月)で開催された。免疫毒性研究会は、当時の日本毒科学会と密接な関係にあるものの、当初の呼びかけの趣旨は次のようなものである。「免疫毒性の研究分野は毒性学の新しい分野にとどまらず、医薬品や環境物質の安全性の予測(Predictive Toxicology)等の実用面において、また生体防御の科学へのアプローチとして基礎面でも、大いに発展・展開しうる分野です。したがって、この研究会を安全性の科学としての毒科学の分野に限定するのではなく、〜(中略)〜 関連学会からの話題提供者を交え、健康・創造の科学としての毒科学研究の進展にも寄与しうるものとしたいと考えております。(『免疫毒性研究会の発足と入会案内』原文の抜粋)」すなわち、免疫毒性学は毒性免疫学という基礎科学に通じる視点を包括する「新時代の安全性の科学」19)と考えたのである。この発足の原動力は、免疫毒性学は新しい科学(海外の研究者は"Young
science"とよく称していた)であるとの期待とともに、国際的な免疫毒性研究の急テンポな進展に比べ、日本においては研究分野としての認知度が今ひとつで研究費申請分野のカテゴリーにもなく、かつ研究集約の場がないことに対する焦りもあったろう。
それまでに、医薬品や化学物質の免疫系に対する毒性関連研究は、欧米を中心に基礎から応用にわたる諸分野で発表されていた。Immnotoxicologyを冠する専門誌(Immunopharmacology and Immunotoxicology)は既に1978に刊行され、toxicologyやpharmacologyの専門誌にもimmnotoxicology関連論文が多く見られるようになっていた。さらに、米国ではITSSのメンバーが中心となり、National Toxicology Program(NTP)からマウスを主とする免疫毒性のスクリーニングパネルが提示(GordonConferenceの際に既に初案が示されていた)され、欧州ではオランダの国立研究所RIVMからラットでのスクリーニング案が提示され、研究方法の体系化が模索されはじめていた。日本では諸分野で研究されるようになったが、研究発表の核となる共通の場が無く、研究内容・効率ともに海外の動きに比べ遅れていた。その遅れをまず取り戻すべく研究会は、当面基礎的・前臨床的な研究を中心に、会員間の研究情報や研究方法の交換(年会の開催とImmunoTox Letterの刊行など)による( 1 )研究のレベルアップ、( 2 )研究分野としての免疫毒性学の確立、また試験法の評価と整備(試験法ワークショップ、免疫毒性試験プロトコールの作成など)により、( 3 )国際的にも対応できる研究連絡の場に育てていくこと、などを方針にして活動を開始した。年会では、免疫毒性学の概念の共有化のために質疑時間を多く取り、試験法ワークショップでは共同研究による試験法の普及などに努めてきたのである。
2 )研究会から学会へ
2001年4 月より研究会は、名倉宏先生を初代会長(=現理事長)として学会(JSIT)に改組された。それまでの7 年の研究会活動を通じて、日本でも免疫毒性学の概念が定着し、研究の方法・技術のレベルはともに格段に向上していた。一方、細胞・分子レベルの基礎研究、および臨床医学や環境保健からの応用研究の進展は、免疫毒性研究の深さや周辺領域との結びつきを急速に増してきた。さらに、前述の免疫毒性試験のガイドライン化と国際調和が推進されはじめ、日本の協議も急務となってきた。これらに対応するため、免疫毒性研究の輪をより広く基礎研究者から臨床医学等の応用研究者へ広げ、かつ研究領域の体系化も試みるべく、当時の名倉代表幹事の発議により学会化することになった21)。
この学会は世界でもユニークなImmunotoxicologyの単立学会として出発している。それは、免疫毒性は生体異物への免疫系の防御反応からその攪乱、それを介する生体障害反応に関わる一連の性質で、従来の「標的毒性」の枠を超える研究対象と考えたことによる。かつてフランスの生理学者Claude Bernard(クロード・ベルナール)は、「毒物は生命体の最も繊細な現象を解析する道具になる」と述べているが、免疫毒性学は複雑な免疫現象を解析する方法論とも解せるからである。この学会では、研究会の初志を継ぎ、試験法や研究結果に対する実質的な意見交換を旨とし、先進的な問題提起と活発な論議による学説の形成の場とすること、さらに、臨床・衛生分野の研究者、毒性学以外の基礎分野の研究者との連携、および欧米の免疫毒性研究組織との連携を進めることを目標として、今日に至っている。
3 .20周年に向けての提言
免疫毒性研究の歩みへの大局的な回顧と展望は、学会20周年に予定されている企画に期待し、ここでは今後の学会の歩みについて若干の事柄を提起してみたい。
1 )免疫毒性研究環境の変化―温故知新
筆者は10周年の大会において、当面する免疫毒性研究の方法上の課題として、1 )免疫毒性試験項目の整理と標準化、2 )薬物や化学物質による自己免疫やアレルギーの実験モデル系の開発と指標の選択、3 )ヒトタンパク製剤の安全性評価のためのヒト細胞モデル系の確立、などの点をあげた。このうち、現時点で目標達成の目途がついているのは、免疫抑制を主とする1 )の課題であり、他のものについては一部を除き、残念ながら未だ実用的な試験法が確立されていない。医薬品については澤田理事長と製薬協の学会員メンバーの努力によるICHの免疫毒性試験ガイドライン(ICHS8)21)が、また、化学物質全般についてはDr. van Loverenが中心となり、手島玲子先生も加わったIPCSのExpert groupによる試験法のガイダンス22)が、それぞれ公表されている。その現時点では、( 1 )試験法の種類と選択、( 2 )免疫亢進(免疫原性、アレルギー誘発性、免疫刺激性)の評価法、( 3 )試験の効率化(In Vitro, In Silico化等)、などがあらためて課題としてあげられる。とくに、研究対象物質ではバイオテクノロジー製品等の生体関連高分子物質の普及にともない免疫原性が重視され、免疫抑制から免疫亢進の評価に研究Needsの比重が移りつつある。これは、免疫毒性研究の出発点において、有害影響の感受性と特異性との二つの視点があったことを先に記したが、免疫抑制の高感受性から免疫亢進の特異性が再び注目されてきたことで、免疫毒性の発現機序における質的特異性の位置づけを見直す必要性を意味するものであろう。
同様のことは、単一の標的臓器としてくくれない標的系の毒性である免疫毒性の研究手法や解釈に、新興のSystems Biology/Toxicologyの考え方を取り込む必要も生じてくるであろう。
さらに、免疫に関する研究内容も変化が著しい。免疫毒性の基礎である免疫の機構において、1 )獲得免疫にもつながる自然免疫の機構、2 )免疫関連分子としてサイトカインなどの情報伝達分子や免疫レセプター、などの解明が進んだことから、免疫毒性の指標や機構の研究にもそれらを考慮しなければならなくなった。とくに、臨床試験におけるサイトカインの大量放出(サイトカイン・ストーム)が生じたTGN1412事件の発生で、黒衣的存在と考えられてきた免疫関連分子が免疫毒性発現の表舞台に出てきたため、免疫毒性概念の修正が必要になっている。また、ナノ物質は自然免疫との関わりが深いことから、免疫毒性の新しい研究対象となりつつある。変異原性や発がん性においては、DNAが標的分子であるとともにバイオマーカーとして位置づけられる。免疫毒性においても、DNAに相当する標的やバイオマーカーが求められ続けてきたが、これら免疫関連分子が指標分子となる可能性は大きいが、それが特異的である説明が必要となる。その候補物質として、免疫反応に関わる各種受容体が近年注目されている。とくに、Ah受容体は、ダイオキシンの免疫抑制作用に関与することが早くから報告されていたが、より広い関わりが近年見出されている。Ah受容体が免疫細胞の分化に関与し、ダイオキシンを始め薬物や天然物質等広範な物質をリガンドとしうる知見23-26) からは、化学物質と免疫系の相互作用においてAh受容体のような分子が、免疫調節分子あるいは毒性発現の標的、あるいはバイオマーカー分子として介在し、新たな機構解明のbreak-throughとなることが期待される。
この他、Allergenicityの定義と評価27-28)、Developmental
immunotoxicologyの方法と位置づけ29-32)、ワクチンや環境中の免疫アジュバント様因子の位置づけ33)など、免疫毒性との関連を整理するべき問題も、その広がりと深さを増している。
これらの課題の多くは古くからあるが、新しい視野が開けてきている、あるいは新しい視点や方法を必要としている課題である。
2 )学会へ提言と期待
これらは、これまで学会でも取り上げられたが残されたままの課題、また新たに生じてきた課題である。これまで、免疫毒性学分野でJSITや学会員から広く世界に発信された情報は、個別のテーマに関連して引用されるが、全般的な免疫毒性のコンセプト形成や試験法ガイダンス作成などの実用面では引用される機会は多くないようである。これらに関して欧米ではグループ討議が盛んで、相互の研究を利用した研究者間のコンセンサス形成が上手な面がある。研究会発足後しばらくは後追い研究が多かったが、学会の活動の歩みと共に、いまや会員諸氏の研究は十分に国際的なレベルに達しているので、積極的な成果の発表とその相互利用を試みてほしい。そのためには、学会がその情報を会員間で共有できる場として機能する必要があろう。手始めに、ITSSのようにImmnoTox Letterに学会員がその年の発表論文を報告し、リストを掲載するのはいかがであろうか。
欧米ではワーキンググループを立ち上げ、年会毎に免疫毒性の先進的課題のシンポジウムやワークショップを設け、課題についての具体的解決を積み重ねている。このため、JSITでも次の10年には研究環境の変化に応じて学会として取り組むべき課題を整理し、優先度と研究指針を示す必要があろう。前述の学会員の発表論文リストを参考として利用するのも一案である。また、シンポジウムやワークショップの後には何が解決しつつあり何が残されているかをまとめることを試み、成果が着実に積み重ねられることを望みたい。
筆者の一方的な提言をお許し頂き、おわりに、学会員諸氏がこれらの課題に挑まれ、本学会の初志である活発な実質的論議を共有する気風が続くよう願いたい。また、会員諸氏の国際経験も以前に増し豊かで頼もしい限りであり、免疫毒性情報の国際的な発信や研究の国際協力に大いに貢献され、JSITが内外の免疫毒性研究のDriving
forceの一環を担うことを期待したい。
(文中の所属は当時のものを記してある。)
[文献]
- J.H. Dean (2004) Int. J. Toxicol., 23: 83-90.
- R.V. House, M.J. Selgrade (2010) Toxicol. Sci., 118: 1-3.
- 大沢基保(2003)ImmunoTox Letter, 8 (2): 6-9.( 第10回日本免疫毒性学会学術大会講演要旨集p.1-3.)
- J.G.Vos (1977) CRC Crit. Rev. Toxicol., 5: 67-101.
- J. Descotes (2004) Immunotoxicology of Drugs and
Chemicals: an Experimental and Clinical Approach,
Elsevier B.V., Amsterdam, p.1-18.
- R.V. House, R.W. Luebke (2007) Immunotoxicology
and Immunopharmacology, 3rd edn. (R.W. Luebke,
R.V. House, I. Kimber, Eds.), CRC Press, Boca Raton,
p.3-20.
- G.L. Floersheim (1978) Schweiz Med. Wochenschr.,
108: 1449-1460.
- D.L. Archer (1978) J. Food Prot., 41: 983-988.
- J.A. Moore (1979) Drug Chem. Toxicol., 2: 1-4.
- 荒川泰昭(2012)ImmunoTox Letter, 17 (1): 1-5.
- M. Ohsawa, M. Kimura (1979) Biochem. Biophys. Res.
Commun., 91: 569-574.
- 大沢基保(1985)トキシコロジー・フォーラム, 8: 609-
613.
- A. Berlin, J. Dean, M.H. Draper, E.M.B. Smith, F.
Spreafico (Eds.) (1987) Immunotoxicology, Martinus Nijhoff Pubs., Dordrecht, p.XXIV.
- J.H. Dean, M.I. Luster, A.E. Munson, H. Amos (Eds.)
(1985) Immunotoxicology and Immunopharmacology,
Raven Press, New York, p.1-511.
- J. Descotes (1986) Immunotoxicology of Drugs and
Chemicals, Elsevier, Amsterdam, p.1-400.
- WHO Task group (1996) Principles and methods
for assessing direct immunotoxicity associated with
exposure to chemicals (Environmental Health Criteria
180), WHO, Geneva, p.1-390.
- 大沢基保(1986)トキシコロジー・フォーラム, 9: 546-
558.
- 大沢基保(1986)医学のあゆみ, 136: 89-93.(他7 回シリーズ講座:免疫毒性)
- 名倉 宏(1986)JSIT Newsletter, No.1: 1-2.
- 名倉 宏(2000)ImmunoTox Letter, 5 (2): 3.
- ICH (2005) Immunotoxicity Studies for Human
Pharmaceuticals S8, p.1-11. (http://www.ich.org/
fileadmin/Public_Web_Site/ICH_Products/Guidelines/
Safety/S8/Step4/S8_Guideline.pdf)
- WHO (2012) IPCS Harmonization project document
no.10: Guidance for immunotoxicity risk assessment
for chemicals, WHO, Geneva, p.1-333.
- F.J. Quintana et al. (2008) Nature, 453: 65-71.
- C. Esser, A. Rannug, B. Stockinger (2009) Cell, 30:
447-454.
- N.B. Marshall, N.I. Kerkvliet (2010) Ann. N.Y. Acad.
Sci., 1183: 25-37.
- V.J. Schulz et al. (2011) Toxicol. Sci., 123: 491-500.
- 澤田純一(2011)ImmunoTox Letter, 16 (1): 3-7.
- ILSI/HESI (2013) Clin. Exper. Allergy, under submission.
(Summary papers of HESI Symposium on Sensitizing
Properties of Proteins, Prague, April 2012)
- R.R. Dietert (2009) Chem. Res. Toxicol., 22: 17-23.
- M.P. Holsapple, R. O'Lone (2012) Toxicol. Pathol., 40:
248-254.
- K. Hochstenbach et al. (2012) Toxicol. Sci., 129: 315-324.
- M. Collinge et al. (2012) J. Immunotoxicol., 9: 210-230.
- A. Batista-Duhatte, E.B. Lindblad, E.Oviedo-Orta
(2013) Toxicol. Lett., 203: 97-105.
|