先ず,新医薬品の製造承認申請において,全身投与を目的とする医薬品の場合は免疫原生(抗原性) 試験を実施し,外用医薬品の場合は皮膚感作性試験ならびに皮膚光感作性試験を実施することになっている。抗原性試験については1988年にガイドライン案が呈示されたが,通知されるには至らなかった。一方,皮膚感作性試験および皮膚光感作性試験については1989年ガイドラインが通知されているが,その実施については特に問題はない。抗原性試験については,1994年7月新医薬品承認審査業務説明会および同年9月医薬品製造管理者講習会において,当局より抗原性試験は次のようにcase-by-caseで対応できることが報告されている。即ち,抗原性試験は,反復投与毒性試験,化学構造からみた抗原性の可能性など,科学的見地からみて特に試験を実施する必要がないと考えられる場合には,試験を実施せずに申請することが可能である。ただしこの場合には,試験を実施しない妥当性について概要書中に記述する必要がある。この試験法については,経験的にモルモットの能動的全身性アナフィラキシー (ASA) 試験ならびに受動的皮膚アナフィラキシー (PCA) 試験が実施されている。
次に,医薬品の免疫機能の抑制に基づく免疫毒性に関しては,現在のところその試験法に関するガイドラインは準備されていない。そこで1992年にJPMAで医薬品の免疫毒性試験の実施現状について調査した結果を分析してみると,JPMA加盟企業 (当時85社) の約1/4の企業が免疫毒性試験を企業独自の判断で実施していることが判明した。実施されている試験の中で既に評価系として確立されている試験があり,それらの試験を列挙すると,細胞性免疫の試験系としてはマイトゲンに対するリンパ球幼若化試験,DTH試験,混合リンパ球培養試験,液性免疫の試験系としては抗SRBC抗体産生によるPFC試験,特異抗体産生試験,非特異的免疫の試験系としてはマクロファージおよび好中球の機能試験が確率されていた。ところで,本邦においても食品添加物については本年3月に通知された「食品添加物の指定及び使用基準改正に関する指針」の中で,28日間,90日間および1年間反復投与毒性試験に免疫関連臓器の病理組織学的検査が追加され,28および90日間反復投与毒性試験では必要に応じ胸腺,脾臓,リンパ節/リンパ様組織の免疫組織化学検査を実施し,免疫毒性が疑われるときは,骨髄構成細胞比,脾リンパ球組成およびNK細胞活性を調べることが要求されている。
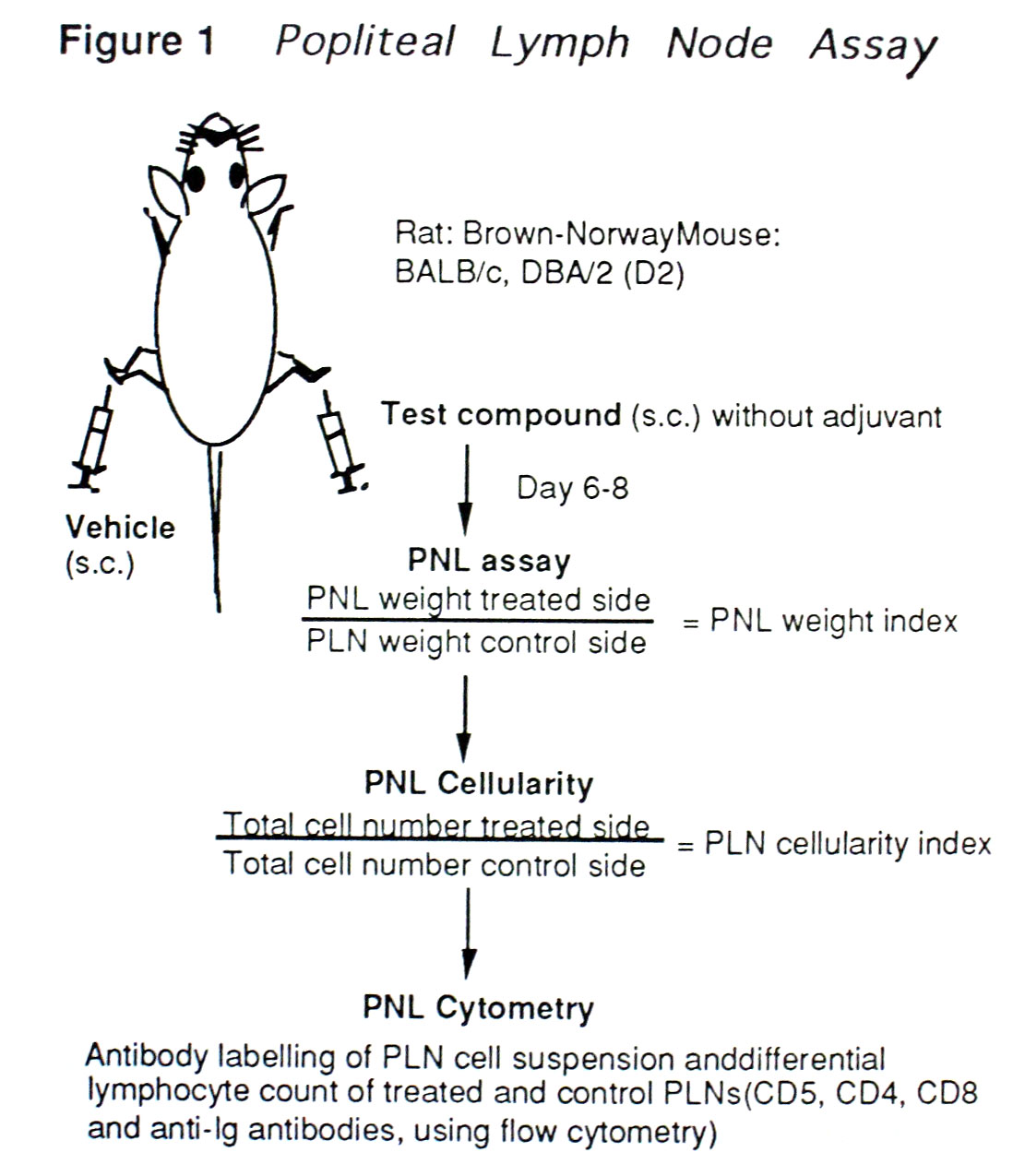
DIAのRound-table DiscussionにおいてDr.J. Dean (Sanofi Winthrop, Inc., USA) よりモルモットを用いた抗原性試験はヒトにおける予知性が,特に低分子薬物において低く,PCA試験はその使用目的が今一つ明確でないとの発言があり,このコメントに関しては我々も理解しているところから,同意する旨の返事に止まった。しかし,Dr.V. Stejskal (Astra, Sweden) より感作モルモットのBリンパ球細胞の幼若化をin vitroで検討することにより,低分子の薬物の抗原性も検討可能であるとの発言があり,モルモットの抗原性試験も手法を変えれば予知性の高い試験法に成りうる可能性が窺えた。また,EUで医薬品の抗原性の検討に広く使用されているMouse Local Lymph Node Assayの一つであるMouse Popliteal Lymph Node Assay (PLNA) の使用について考えを求められたが,文献的には見ているが使用経験がないことから,この件については本邦における今後の検討課題であると返答した。しかしながら,このMouse PLNAについてはEUにおいて既に動物とヒトにおけるアレルギー発現の相関性が調べられ,高い相関性を得ていることから,本那においても早急に検討する必要がある。そこで,このMouse PLNA についてDr. R. Albers (State University of Utrecht, The Netherlands) の発表を基にその特徴と問題点を簡単に纏めてみることにする。Mouse PLNAは化学物質に対する免疫系の局所反応を検討するために使用されている。PLNAのパラメータとしては,膝下リンパ節の重量 (PLN Weight Index) ,膝下リンパ節の細胞数 (PLN Cellularity Index) ,リンパ球のサブセット (PNL Cytometry) が挙げられる。PLNAはBrown-NorwayラットあるいはBALB/cまたはDBA/2マウスを使用して実施されており,被験物質はアジュバントを使用せず,後肢の一足の足蹠皮下に,他足には溶媒をそれぞれ1回注射し,6~8日後に膝下リンパ節を測定する (Figure1, Popliteal Lymph Node Assay)。
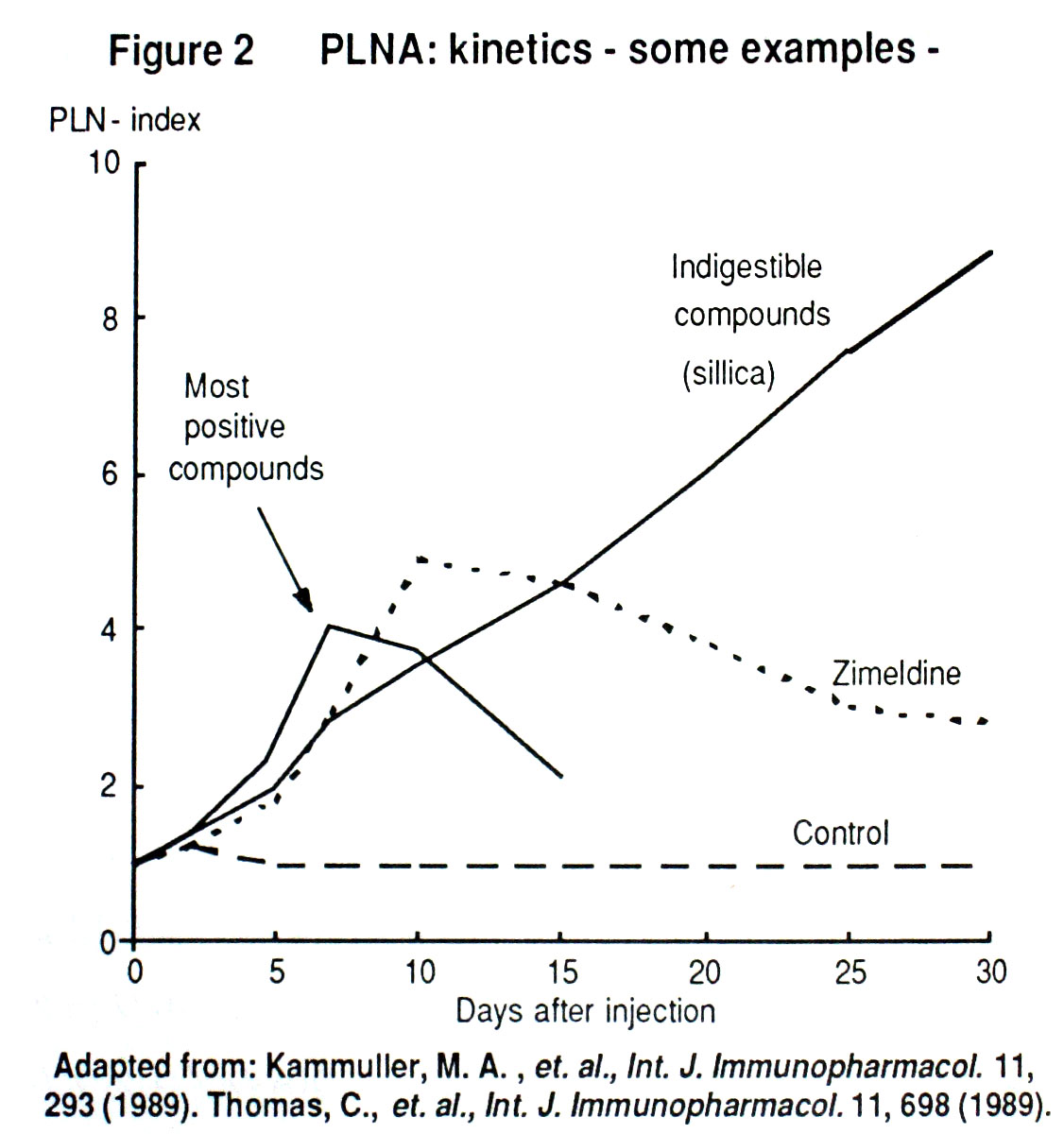
本試験の予知性について60種類以上の化合物を用い,ヒトで免疫学的副作用 (allergyあるいはautoimmune) を誘発することが明らかな化合物と免疫系に作用を及ぼさない化合物について検討し,前者については全て陽性の結果が示され,後者については陰性の結果が得られている。問題点は,procainamideやpropylthiouracilなどの代謝物が反応に関与する化合物では偽陰性となり,aceton,ethanol,sillica,imipramineなど刺激作用を有する化合物では偽陰性を示すことにある (Figure 2, PLNA:kinetics)。
最後にPLNAの特徴,落とし穴および限界をまとめたものをTable1 (summary) に示す。

以上,医薬品の免疫毒性試験の現状について,諸外国の事例も交えその概略を述べた。会員の皆様の研究の一助になれば幸いである。