1999年12月16日に欧州医薬品審査庁 医薬品委員会(EMEA/CPMP)が免疫毒性ガイダンス案を公表し,また米国食品医薬品庁 医薬品評価研究センター(FDA/CDER)も当時同様のガイダンス案を検討していたことから,本件に関する国際的ハーモナイゼーションが必要になってきたものと思われた。日本製薬協は,免疫毒性試験をICH新規トピックとして提案することを決め,厚生省(当時)の御協力を仰いだ。そして,2000年11月7日のICH運営委員会会議において免疫毒性試験をICHトピックとして共同提案するに至った。なお,その間EMEA/CPMPは2000年7月21日に免疫毒性ガイダンスを最終化し,FDA/CDERも2000年8月24日に第2回アジアトキシコロジー学会で検討案を発表していた。ICH運営委員会会議においては,FDA/CDERが次回のICH東京会議までに自らの正式ガイダンス案を公表すると表明,EUをはじめ他の団体もFDA/CDER案を見てからトピック化を判断したいとし,次回の東京でのICH運営委員会会議で再度審議されることになった。
ICH東京会議は翌2001年5月19日〜24日の会期で開催されたが,FDA/CDERは直前の5月10日に免疫毒性評価ガイダンス案を公表した。FDA/CDERガイダンス案はEMEA/CPMPガイダンスの内容とは相いれないものであった。5月23日の運営委員会会議でFDA/CDERは,これまで国内においてリソースをつぎ込み何年もかけてガイダンスを作ってきたということを理由にトピック化に難色を示した。一方,欧州製薬団体連合会(EFPIA)は,前回のICH運営委員会でFDA/CDERガイダンス案を見てからトピック化を検討するはずではなかったかとしトピック化に賛成した。議論は平行線のままであったが,議長であった厚生労働省の佐藤大作 専門官による提案で,次回ICHブリュッセル会議において非公式専門家会議を開き,この問題を検討することになった。
EUさらにはFDA/CDERが免疫毒性試験に関するガイダンス(案)を公表するなか,日本においてもガイダンスが検討されることになり,医薬安全総合研究事業の一環として「免疫毒性試験法の標準化に関する調査研究」(分担研究責任者:澤田純一 国立衛研 機能生化学部長)において免疫毒性試験法ガイダンス中間案が作成された。この中間案の英訳文は2001年12月20日に厚生労働省と日本製薬協による免疫毒性試験法ガイダンス中間案としてICH運営委員会へ提出された。
ICH非公式専門家会議はブリュッセル会議にあわせて2002年2月7日に開催された。FDA/CDERと米国製薬協(PhRMA)は,この時点でトピック化されればICHガイドラインがEUガイダンスに強く影響されるという懸念を持っていた。会議の中でFDA/CDERとPhRMAは,今後各製薬企業が各極ガイダンスに従って実施した試験データや学会などを通じて得られた基礎データをもとにICHガイドラインを議論すべきでありトピック化は時期尚早であると主張した。当方はICHの枠内でもデータ収集はできると反論した。結局,トピック化には6団体中4団体(すなわち,厚生労働省,日本製薬協,EU,EFPIA)の賛成が得られたものの,可決には全会一致の賛成が必要であることからトピック化には至らなかった。しかし,将来ガイドラインをハーモナイズすることは合意され,2003年11月に大阪で開催されるICH6において科学的データを持ち寄り検討会が開かれることになった。ICH運営委員会会議に提出された非公式専門家会議のまとめは以下の通りである。
1.Immunotoxicity assessment is important.
2.We all agree that we should eventually harmonize.
3.We all agree that more data are needed to evaluate the appropriateness of the current guidelines.
4.We reviewed the background for each of the guidelines. Key differences are a result of different interpretations of limited data.
5.2 of 6 ICH parties felt we should not make immunotoxicology a topic for ICH at this stage.
6.We recommend use of scientific groups outside the ICH to facilitate the process of data gathering through regulatory submissions and scientific collaborations.
7.We recommend that a scientific session on immunotoxicity testing should be included in the ICH6, Osaka, 2003 for a further discussion among the six parties.
今後,各極の行政当局および製薬業界は医薬品の免疫毒性に関する申請資料用データや基礎データの蓄積を行っていくことになる。現在,PhRMAの代表者の働きかけで,民間の団体であるInternational Life Science Instituteが中心となって日米欧の免疫毒性データベースを構築する動きがある。また,日本製薬協が主催した,まさに「医薬品の免疫毒性評価手順を検討するための共同研究」の結果も注目されており,日本製薬協としても今後さらにデータ収集に努めたいと考えている。
最後に各極のガイダンス(あるいは案)を簡単に比較してみたい(Table 1)。
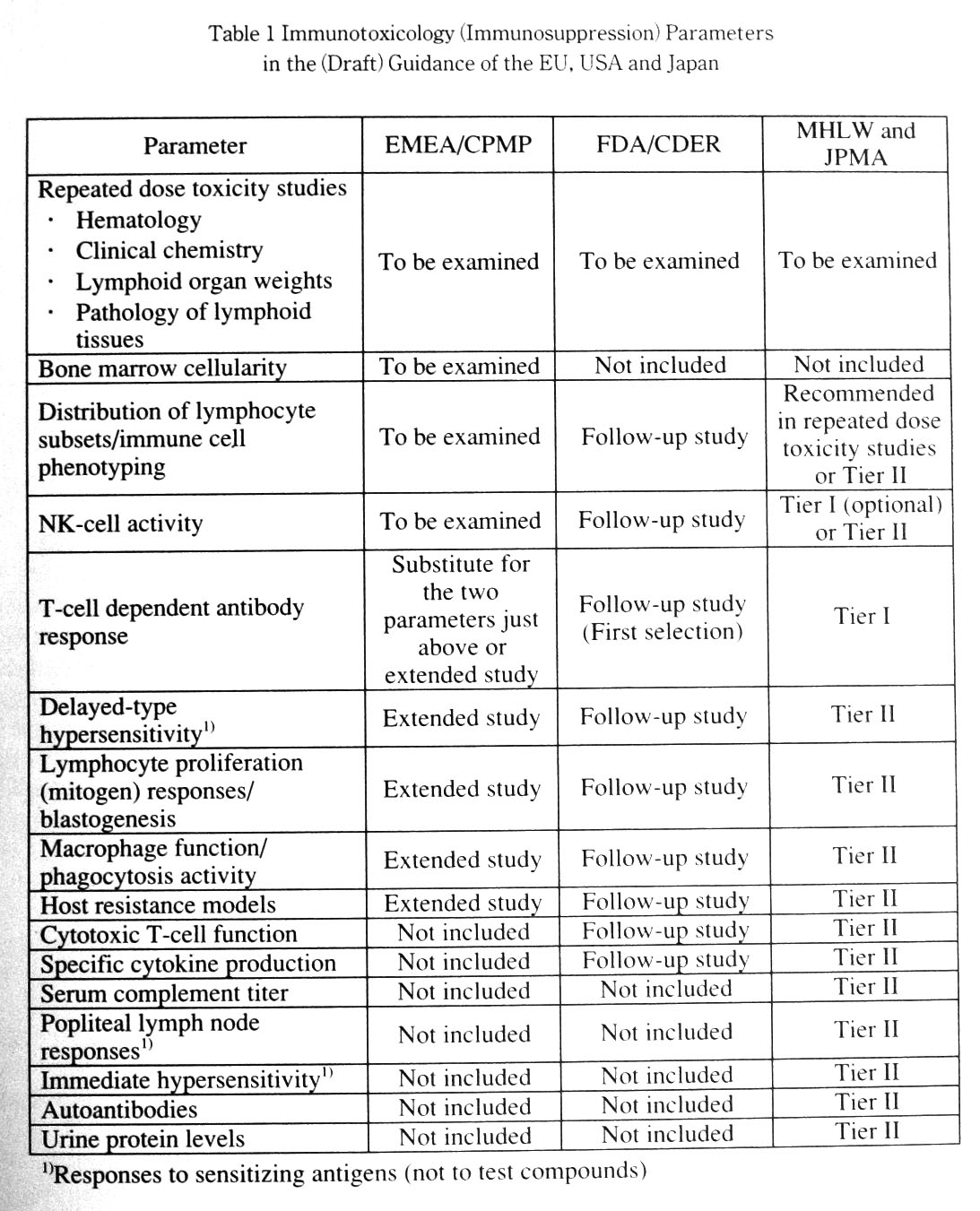
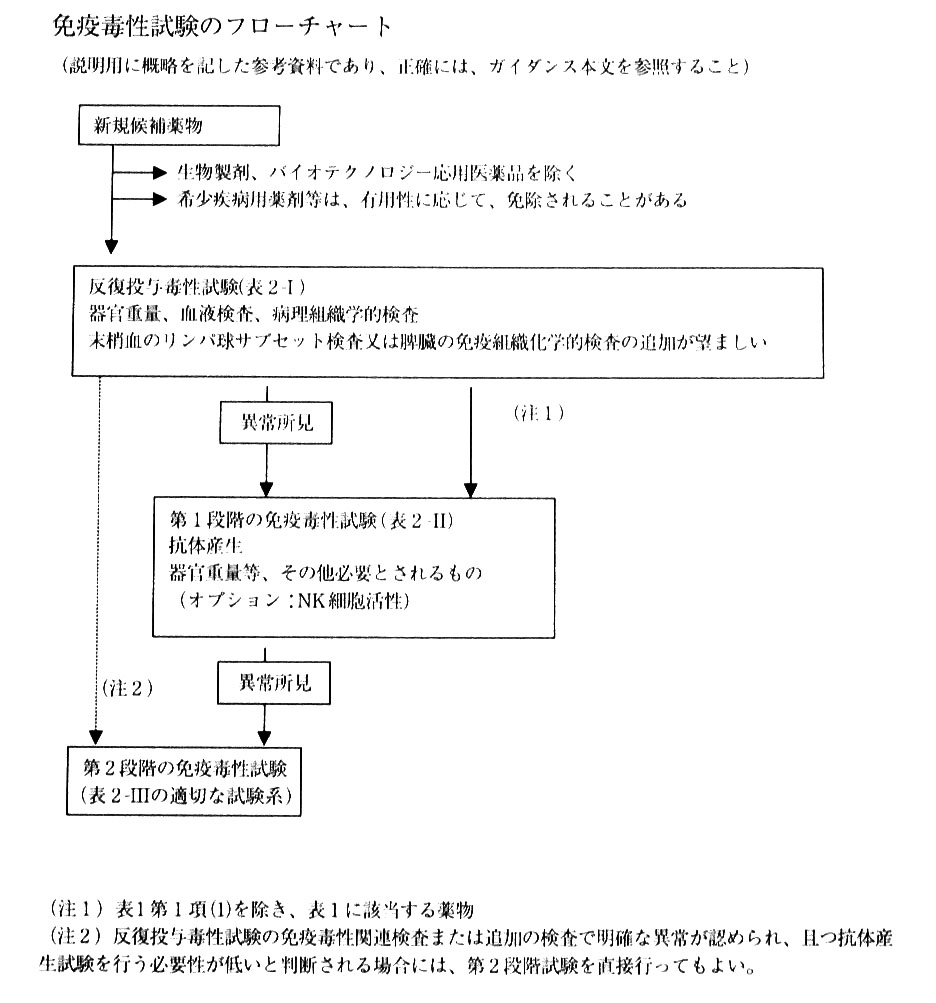
EMEA/CPMPのガイダンス(http://www.emea.eu.int/htms/human/swp/swpfin.htm)では,全ての新規医薬品について骨髄細胞数に加え,リンパ球サブセットの分布とNK細胞活性,あるいはT細胞依存性抗原に対する抗体産生反応を調べることになっている。FDA/CDERのガイダンス案(http://www.fda.gov./cder/guidance/3010dft.htm あるいはhttp://www.fda.gov./cder/guidance/3010dft.pdf) に関しては,2001年11月19日〜20日に開催されたDIAワークショップにおいてFDA/CDERの専門官が今後さらなる変更の可能性があるとしながらも原案の修正案を発表している。修正案によれば,一般的には通常の毒性試験で免疫毒性所見が認められた化合物についてはまずT細胞依存性抗原に対する抗体産生反応(当初の案では,まずリンパ球サブセットの解析)を調べることを勧めている。ただし,HIV感染症治療薬などの場合は通常の毒性試験の結果に関係なく免疫機能検査を実施する必要があるとしている。一方,日本のガイダンス中間案では,反復投与毒性試験において末梢血あるいは脾臓のリンパ球サブセットの解析を追加することが勧められ,反復投与毒性試験で免疫毒性所見が認められた化合物に関してはまずT細胞依存性抗原に対する抗体産生能について調べる。また,この時点でNK細胞活性について追加してもよい。さらに,免疫毒性を示す薬物と化学構造の類似性のある薬物,免疫不全症や免疫抑制作用を有する薬剤との併用が臨床適応となっている薬物などについては免疫機能検査を行うこととしている。いずれのガイダンス(あるいは案)においても段階的評価法がとられており,その他の免疫機能検査については必要に応じて実施していく。なお,FDA/CDERのガイダンス最終案は既に出来上がっている。今後,日本国内のガイダンスをどのようにするかについても焦点になっていくであろう。
このように,医薬品の免疫毒性試験法について,ようやく国際的ハーモナイゼーションの大きな流れができたが,何よりも国際的な議論がなされるようになったことは重要だと考えている。今後とも,皆様から御意見さらには各種免疫毒性データを御寄せいただければと思います。