 | 
 |
 |
 |
 |
≪第12回大会 年会賞≫
低濃度アスベスト暴露に誘導される肺胞マクロファージの生存延長と持続的TGF-β1産生能亢進
The prolonged survival and the long-lasting production of TGF-beta1 in the alveolar macrophages induced by the low exposure to asbestos |
 |
 |
 |
 |
西村泰光1、和田珠子2、和田安彦3、三浦由恵1
大槻剛巳1、細川友秀4、井口 弘3
1川崎医科大学 衛生学、2大手前短期大学 ライフデザイン学科
3兵庫医科大学 環境予防医学、4京都教育大学 生命科学 |
 |
目的
肺胞マクロファージ(AM)は気管支肺胞内に侵入する異物の除去に働く免疫担当細胞である。AMは、アスベスト(石綿)暴露後の肺炎症反応においても重要な役割を持つ。石綿暴露後、AMはスーパーオキシドアニオンなどの活性酸素種1)、NOなどの活性窒素種2)、LTB4などの化学誘引物質、TNF-αなどの炎症性サイトカインを産生する3、4)。その結果、組織障害と修復が繰り返され、コラーゲン、フィブロネクチンなどの細胞外マトリックス(ECM)が多量に蓄積し、肺は線維化が進行、つまり石綿肺になるとされている5、6)。事実、TNF-αは、ECMの産生を誘導するTGF-βの産生に極めて重要であり、TNF-α受容体欠損マウスを用いた実験では、石綿暴露後のTGF-β産生およびECM蓄積が減弱化している6、7)。また、石綿は肺上皮細胞、中皮細胞およびAMにアポトーシスを誘導するが8)、実験的に誘導されたアポトーシス細胞の気管内注入またはエアロゾルによる吸入が肺線維化を誘導することも報告されている9、10)。そのように、これまで石綿暴露による肺線維化は、AMによるTNF-α産生を中心とした炎症反応にTGF-β産生が続き、これに誘導されるECMの過剰産生によるものであると説明されている5)。しかし、AM自身もTGF-βを産生すること6)を鑑みると、石綿暴露下においてAMがTGF-β産生を介して直接的に肺線維化に働いている可能性は否定できない。AMの産生するTGF-β総量は少ないかもしれないが、TGF-β産生はTGF-β自身に正に制御されているので11)、AM由来のTGF-βが各所でTGF-β産生を誘導し肺線維化を緩やかに進行させる可能性が想起される。そこで、我々は本研究においてラットの石綿気管内注入実験、および石綿暴露下でのAM培養実験を行い、石綿暴露後のAMのTGF-β1産生能について、および石綿暴露濃度の影響について調べた。その中で、AMが自立的にTGF-β1産生能を亢進する可能性、およびAMのTGF-β1産生能とアポトーシスとの関連性、について検討した。加えて、石綿暴露下 のAM培養における多核巨細胞(MGC)の生成条件を調べ、石綿暴露時のMGC生成の仕組みを考察した。
方法
8週齢雄性Wistarラットに4mgの白石綿クリソタイルB(CH)または生理食塩水を気管内に注入し石綿暴露を行った。5日後、ネンブタール麻酔下HBSSで灌流した肺を摘出し、気管支肺胞洗浄液(BALF)を得た。BALFより付着細胞として単離したAMをCH暴露下で培養した。一部、培養5日以降に3日置きに上清を回収し新しい培地と交換した。回収したBALF中および培養中におけるTGF-β1産生量をELISAにより、アポトーシス細胞をFITC標識 annexin V染色法および PIを用いたDNA量定量法によりflow cytometryを用いて定量した。PE標識抗Bcl-2、Bcl-xL抗体を用いて細胞内染色を行いflow cytometry によりBcl-2、Bcl-xL発現量を定量した。
結果
CH気管内注入5日後のBALF中ではTGF-β1産生量が有意に高く、アポトーシス細胞が有意に増加していた。また、CH注入群のBALF中にはMGCが多く観察された。CH注入群のBALFより回収されたAMは生食注入群(対照群)のAMに比べ、培養5日後、有意に高いTGF-β1産生量を示した。しかし、対照群AMも10μg/ml CH暴露下で培養した時、同じ程度に高いTGF-β1産生量を示した。高濃度CH暴露下のAM培養時にはAnnexin V陽性のアポトーシス細胞比率が増加し、50μg/ml 以上のCH濃度で明瞭に増加したが、5-10μg/mlのCH暴露下ではアポトーシスをほとんど起こさなかった。対照的に、AM培養5日後(Day5) のTGF-β1産生量は10μg/ml CH濃度でピークを示し、25μg/ml以上の高濃度では増加しなかった。5-10μg/ml CH濃度下のAMは、続く3日間(Day5 to 8)以降もTGF-β1産生能の亢進を維持し、産生量のピークはより明瞭であった。また、その次の3日間(Day8 to 11)では産生量は更に増加し、より高値を示した。培養3日後AM中の Bcl-2、Bcl-xL発現量は10μg/ml CH濃度で増加し、特にBcl-xLで顕著であった。また50μg/ml CH濃度下の残存AM中の発現量は更に増加していた。AM培養5日後まではどのCH暴露濃度においてもMGCは高頻度に生成されなかった。しかし、5-10μg/ml CH濃度下では培養11日以降には高頻度に多数のMGCが観察された。他方50μg/ml 以上のCH暴露下では大部分のAMは死滅していた。
考察
CH注入群由来AMは高いTGF-β1産生能を示したが、in vitroでCHに暴露されたAMは同じように高いTGF-β1産生能を獲得した。このことは、AMはCH暴露後に自律的に高いTGF-β1産生能を獲得し、この機能亢進には気管支肺胞を構成する他の細胞は必要ない事を示す。CH注入群のBALFにはアポトーシス細胞が多数存在し、同時にBALF中のAMは高いTGF-β1産生能を示した。しかし、in vitroのCH暴露で誘導されるアポトーシスとTGF-β1産生能における暴露濃度依存性は大きく異なり、前者が50μg/ml以上の高濃度で明瞭に誘導されたのに対し、後者は5-10μg/mlの濃度で亢進した。これらの結果は、AMにおけるTGF-β1産生能の亢進は増加したアポトーシス細胞に依存せず、AMはアポトーシスを誘導しない低濃度のCHに暴露された時に自律的に高いTGF-β1産生能を獲得することを意味する。さらに、低濃度CHに暴露されたAMは長期に生存し、高いTGF-β1産生能を維持し、培養日数が延びるに従いTGF-β1産生能も更に亢進した。このことには、CH暴露によるBcl-2とBcl-xLの増加、および産生されたTGF-β1による正のTGF-β1産生制御11)が寄与していると考えられる。このように、本研究では、AMが比較的低濃度のCHに暴露された時に高いTGF-β1産生能を自律的に獲得し、長期に生存しTGF-β1産生を維持することを明らかにした(Figure 1)。このことは、高濃度石綿暴露が強い組織障害や細胞死を伴い肺線維化を惹起することに加えて、低濃度の石綿暴露は高いTGF-β1産生能と生存能を持つAM(pro-fibrogenic AM)を誘導し、これに起因して肺線維化や免疫機能の異常を招く可能性があることを示唆する。このようなpro-fibrogenic AMはin vivoにおいて気管支肺胞内腔および組織内を移動し、TGF-β1を産生し続け、周辺の肺上皮細胞や線維芽細胞にTGF-β1産生を誘導する可能性がある。そうして産生されたTGF-β1は各所でECM産生を誘導し、肺線維化を漸進させるだろう。加えて、TGF-β1の免疫抑制作用12)や制御性T細胞誘導作用13)は抗腫瘍免疫に負の効果を示すと考えられ、pro-fibrogenic AMが石綿肺だけでなく中皮腫発症にも関与する可能性が示唆される。慢性炎症時に出現するMGCは単球マクロファージの細胞融合により生成されることが分かっているが、未だ機能は明らかではない。今回、MGC生成が低濃度CH暴露下AM培養時に見られたことは、MGCとpro-fibrogenic AMとの関連性を示唆する知見である。今回の研究成果は、既存の概念に加えて、低濃度CH暴露が高い生存能とTGF-β1産生能を持つpro-fibrogenic AMを誘導することを明らかにし、CH暴露後のAMにおける機能変化が直接的に肺線維化および免疫機能低下に寄与する可能性を提唱するものである。現在、我が国における石綿関連疾患は、職業暴露だけでなく非職業暴露による疾患が社会問題になっており、その多くは低濃度長期暴露であると予想される。今回の研究成果は、これらの問題に寄与する材料になるかもしれない。
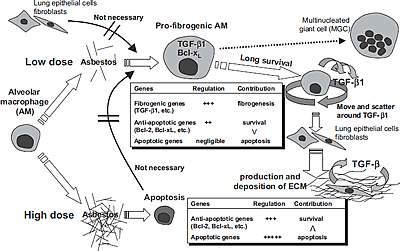
Figure 1. Alveolar macrophages can acquire the increased abilities to survive and produce TGF-β1 under the low dose exposure to asbestos. |
文献
1) Kamp DW, Graceffa P, Pryor WA, Weitzman SA. The role of free radicals in asbestos-induced diseases. Free Radic Biol Med. 1992;12:293-315.
2) Iguchi H, Kojo S, Ikeda M. Nitric oxide (NO) synthase activity in the lung and NO synthesis in alveolar macrophages of rats increased on exposure to asbestos. J Appl Toxicol. 1996;16:309-15.
3) Li XY, Lamb D, Donaldson K. The production of TNF-alpha and IL-1-like activity by bronchoalveolar leucocytes after intratracheal instillation of crocidolite asbestos. Int J Exp Pathol. 1993;74:403-10.
4) Dubois CM, Bissonnette E, Rola-Pleszczynski M. Asbestos fibers and silica particles stimulate rat alveolar macrophages to release tumor necrosis factor.
Autoregulatory role of leukotriene B4. Am Rev Respir Dis. 1989;139:1257-64.
5) Mossman BT, Churg A. Mechanisms in the pathogenesis of asbestosis and silicosis. Am J Respir Crit Care Med.1998;157:1666-80.
6) Liu JY, Brody AR. Increased TGF-beta1 in the lungs of asbestos-exposed rats and mice: reduced expression in TNF-alpha receptor knockout mice. J Environ Pathol Toxicol Oncol. 2001;20:97-108.
7) Liu JY, Brass DM, Hoyle GW, Brody AR. TNF-alpha receptor knockout mice are protected from the fibroproliferative effects of inhaled asbestos fibers. Am J Pathol. 1998;153:1839-47.
8) Hamilton RF, Iyer LL, Holian A. Asbestos induces apoptosis in human alveolar macrophages. Am J Physiol. 1996;271:L813-9.
9) Hagimoto N, Kuwano K, Miyazaki H, Kunitake R, Fujita M, Kawasaki M, Kaneko Y, Hara N. Induction of apoptosis and pulmonary fibrosis in mice in response to ligation of Fas antigen. Am J Respir Cell Mol Biol.1997;17:272-8.
10) Wang L, Antonini JM, Rojanasakul Y, Castranova V, Scabilloni JF, Mercer RR. Potential role of apoptotic macrophages in pulmonary inflammation and fibrosis.
J Cell Physiol. 2003;194:215-24.
11) Miyazono K. Positive and negative regulation of TGF-beta signaling. J Cell Sci. 2000;113 (Pt 7):1101-9.
12) Shull MM, Ormsby I, Kier AB, Pawlowski S, Diebold RJ, Yin M, Allen R, Sidman C, Proetzel G, Calvin D, et al. Targeted disruption of the mouse transforming growth factor-beta 1 gene results in multifocal inflammatory disease. Nature. 1992;359:693-9.
13) Chen ZM, O'Shaughnessy MJ, Gramaglia I, Panoskaltsis-Mortari A, Murphy WJ, Narula S, Roncarolo MG, Blazar BR. IL-10 and TGF-beta induce alloreactive CD4+CD25- T cells to acquire regulatory cell function. Blood. 2003;101:5076-83. |
|
|