この度は、第20回学術大会シンポジウムにお招きいただきまして大変有り難うございました。環境医学、社会医学的側面のみならず薬理学的観点から生体への免疫毒性を熱心に議論されていることに感銘を覚えました。ここに、私が講演いたしました内容に加筆して臓器線維化の機序について私の考えを記します。
内的・外的環境因子による生体への過剰な持続的侵襲により慢性炎症が永続的に持続、様々な臓器に線維化が起こります。Collagen I(Col I)をはじめとする細胞外基質の蓄積である線維化は、創傷の治癒に観られるように本来重要な生体防御反応でありますが、過剰な蓄積は重篤な臓器機能不全をもたらします。代表的線維化疾患としては、1 )特発性間質性肺炎(IIPs):原因を特定しない間質性肺炎の総称であります。特発性肺線維症(IPF)は、人口10万人あたり20名程度と推測され、慢性進行性で発症後、50%生存が3 年とされる非常に予後不良な疾患であります。2 )肝硬変:我が国におけるC型肝炎ウイルスとB型肝炎ウイルスの感染者は350万人存在し、肝硬変(C型肝炎65%、B型肝炎12%、NonB/NonC4.3%、アルコール性肝炎13%)による死亡数は毎年1 万5 千人に上り、3 万数千人が死亡する肝細胞癌の基盤をなします。また、1 千万人程度に非アルコール性脂肪肝(NASH)を認めるとされますが、多くが将来肝炎、肝硬変になり、終には肝癌になる人もいることも明らかとなってきています。3 )腎硬化症:慢性糸球体腎炎による透析導入患者数は減少する一方、糖尿病性腎症が原因の腎線維化による腎不全透析患者は毎年増加し(30万人)、透析医療費は1 兆数千億円に達し国民総医療費の4 %を占め、医療経済的にも重大な問題となっております。4 )関節リウマチ:推定患者数は70万人で患者の15〜30%に間質性肺炎が合併する一方、IIPsの3 割に自己免疫疾患が関与すると言われています。5 )社会医学分野では、シリカやアスベストによる肺線維症などがあります。塵肺症と言えば、古くて新しい問題であり、最近の中国大陸からの越境PM2.5+黄砂問題は慢性呼吸器疾患、肺癌との関連で大きな社会的関心事に成っております。このように線維化疾患には重大な難治性の疾患が多々含まれます。それ故、医学的にも、社会的にも線維化機序を解明し、それに立脚した疾患予防・新規治療法を確立することは喫緊の課題であります。
線維化をもたらす線維芽細胞、筋線維芽細胞の起源に関する論争
1 )1994年Bucalaらによって発見された線維細胞(fibrocyte)は、骨髄由来細胞(CD45+CD11b+HLADR+)でありながらCol I, VimentinなどのECMを発現する細胞であり、血液循環を介してケモカイン受容体CXCR4やCCR1/2/5/7などとそれらのリガンド依存性に炎症組織に動員される、と報告されています。しかし、最近では、種々のマウス線維化モデルにて骨髄移植、併体接合を実施する事により線維細胞の臓器線維化への寄与度についてはミニマムである、とする報告が多くみられます。2 )各種動物線維症モデルにて正常上皮細胞が上皮間葉系移行(EMT)によって筋線維芽細胞に移行し、Col Iの主な産生細胞になる、とする論文が近年多く発表されました。しかし、最近のCell-Lineage Tracingによる厳密な解析によっては炎症組織における上皮のEMTは実証されず、電子顕微鏡像においても基底膜を超える上皮細胞像が観られない、などにより損傷上皮細胞のEMTに関しては疑問が投げかけられています。3 )肝臓研究分野においては、従来から類洞血管周囲細胞pericyteであるVitamin A貯蔵細胞Stellate Cell(Ito細胞)がCol I産生性線維芽細胞、筋線維芽細胞の主な前駆細胞とされてきました。最近、臓器線維化をもたらす細胞の起源、系列としてCell-Lineage Tracingを実施し、腎臓、脳などの臓器においても血管周囲細胞がCol I産生性線維芽細胞、筋線維芽細胞の主な前駆細胞と認識され、一般化しようとしています。一方、Cell-Lineage Tracingに用いられているNG2、FoxD1などが必ずしも血管周囲細胞特異的でないことにより、反論論文も出ています。現時点では、炎症に伴い、血管周囲の間葉系細胞ならびに常在性線維芽細胞の活性化・分化・移動により臓器線維化が引き起こされる、というのが妥当なところと思われます。
線維化に関与する白血球と炎症介在因子
慢性炎症部位に浸潤するマクロファージは、一般的にはprofibroticなM2タイプ(CD206+, chinase-3-like protei-3(Ym1), resistin-like molecule-a(Relm-a, FIZZ-1),Arginase 1など陽性)にシフトしています。また、浸潤T細胞においても炎症の慢性化に伴いTh1からTh2へのシフトが起こり、Th2サイトカインはケモカイン産生誘導を介して好酸球浸潤を促し、線維化を増悪化させるとされています。一方、NK/NKTのみならず最近注目されているmast cellやTh17、Treg、natural helper細胞などの新たな免疫細胞サブセットの関与については今後の検討が待たれます。
慢性炎症に伴う上皮細胞の損傷とその修復においては、Wnt/beta-Cateninシグナル経路やBMPsは上皮細胞修復に促進的に働き、筋線維芽細胞の分化・活性化・移動にはTGFβが中心的に関わると言われております。BMPとTGFβは細胞内シグナル伝達において拮抗的関係にあります。Wnt阻害、BMP結合蛋白の阻害が腎臓の線維化を抑制する事が報告されています。この他CTGF、PDGF、AT、LTs、PGs、LPA、S1PなどのGPCRに作用する生理活性物質、 Osteopontin、血漿成分factor VII-XaとThrombin、メタロプロテアーゼとそれらの阻害蛋白も臓器線維化に寄与する、という報告があります。
私達の研究紹介:肺線維症マウスモデルにおいて線維芽細胞の増殖より質的変化が重要(Amer. J. Pathol. 2013T. Tsukui et al.)
Col1α2-GFPマウスの肺においては、肺胞壁に存在する線維芽細胞と血管周囲の平滑筋細胞がGFPを発現しており、その細胞数の比はおよそ7 : 3 でした。ブレオマイシンにより線維化を誘導すると、GFP陽性細胞がクラスターを作り、I型コラーゲンが豊富に存在する線維化領域を形成していました。しかし、フローサイトメトリーにより肺全体の線維芽細胞数を計測したところ、線維化のピーク時においても細胞数の変動は見られませんでした。ブレオマシン投与後14日目の肺から単離された線維芽細胞は、細胞の大きさの増加、細胞内小器官の発達、筋線維芽細胞のマーカーであるα-smooth muscle
actin(α-SMA)の発現亢進が見られました。細胞周期インディケーターFucciマウスや、細胞死インディケーターSCAT3.1マウスを用いて線維芽細胞の細胞増殖や細胞死を調べたところ、いずれもブレオマイシン投与後7 日目に最も亢進していました。これらのことから、線維芽細胞はブレオマイシン誘導性肺線維症モデルにおいて細胞増殖と細胞死が同時に亢進した動的平衡状態にあることが示唆されました(図1 )。ただし、細胞増殖、細胞死いずれもピーク時において線維芽細胞全体の数%程度であり、線維化領域における線維芽細胞のクラスターは増殖だけでなく細胞移動によっても形成される可能性が示唆されました。
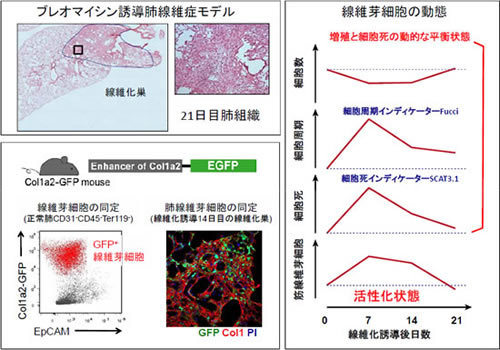
図1 フローサイトメトリーおよびレポーターマウスを用いた定量的な線維芽細胞の動態解析 |
終りに
未だどの細胞サブセット、機能分子を標的としても有効な線維化疾患予防・治療薬は開発されておりません。それは、何より私達は未だ慢性炎症に伴う臓器線維化の細胞・分子基盤を十分理解していないこと、なぜ炎症が慢性化・不可逆的になるのかそれらの機序を理解していないからです。本学会の皆さんとともにこれらの重大な問題の謎解きを行って、社会に貢献できたら幸いです。 |